Veja a parte 1 desta série SUA PARTICIPAÇÃO FAZ A DIFERENÇA.
Fungos micorrízicos arbusculares [AM] são fungos naturais encontrados na maioria, senão em todos, os solos. Eles colonizam as raízes da maioria das plantas cultivadas para formar uma simbiose mutualística (benéfica para ambos os parceiros). Entre as plantas que não formam essa simbiose, notáveis são os membros da família da mostarda (por exemplo, colza, brócolis), espinafre e beterraba sacarina. Os fungos AM auxiliam as plantas na absorção de nutrientes minerais do solo e aumentam a resistência a doenças e à seca. O principal benefício para as plantas é a maior absorção de nutrientes minerais, como fósforo, zinco e cobre, que são "imóveis" na solução do solo; isto é, eles não se dissolvem bem na água do solo e, portanto, não se movem em direção às raízes à medida que as plantas retiram água do solo. Na ausência de fungos micorrízicos, esses nutrientes podem ser absorvidos a uma distância de apenas 1-2 mm da raiz. Os filamentos filiformes (“hifas”) dos fungos AM externos à raiz se estendem a 8 cm ou mais da raiz, aumentando drasticamente o volume de solo do qual esses nutrientes imóveis podem ser extraídos.
Dados esses benefícios, uma melhor utilização da simbiose AM é atraente para os agricultores, especialmente os agricultores orgânicos que procuram minimizar os insumos fora da fazenda. Os agricultores têm duas opções para isso: 1) adotar práticas de manejo que aumentem o funcionamento de suas populações nativas de fungos AM ou 2) inocular com fungos AM. Restrições econômicas e práticas tornam a opção 1 o caminho provável para os agricultores de safras em linha. Os produtores de vegetais que cultivam suas próprias mudas para plantio no campo podem usar inóculos de fungos AM de maneira eficiente e econômica.
O inóculo de fungos AM está disponível comercialmente, mas os agricultores podem cultivar o inóculo dos fungos AM nativos de suas fazendas usando um método simples e confiável desenvolvido por meio de uma colaboração do USDA e pesquisadores do Rodale Institute.
O método
Princípios gerais
- Os fungos AM são “simbiontes obrigatórios”, o que significa que precisam colonizar uma planta hospedeira para crescer e completar seus ciclos de vida. Isso significa que, para produzir inóculo desses fungos, é necessário fornecer acesso às plantas, em particular às raízes vivas das plantas. Aqui, usaremos mudas de capim-bahia (Paspalum notatum). Bahiagrass é um bom hospedeiro para fungos AM e não é resistente ao inverno em climas temperados. Portanto, não se tornará uma praga de ervas daninhas no inóculo. Outras espécies de gramíneas devem funcionar como planta hospedeira, mas uma vai querer ter certeza de proibir a produção de sementes.
- Portanto, é necessário fornecer as coisas que a planta precisa para crescer: nutrientes, água e luz solar. Os nutrientes são fornecidos por meio de composto. O meio em que as plantas são cultivadas e, portanto, em que o inóculo é produzido, é uma mistura de 1: 4 (base em volume) de composto e vermiculita. Localize o sistema de produção de inóculo em plena luz do sol e água conforme necessário.
- Por último, é necessário um "inóculo inicial". O projeto original deste método (ver recurso no. 1, abaixo) envolveu a produção inicial de mudas de capim-bahia em uma mistura de envasamento inoculada com espécies individuais de fungos AM. A esperança era que, após a demonstração do sucesso do método, fontes comerciais disponibilizassem as plantas de capim-bahia “pré-colonizadas”. Isso não aconteceu, daí a necessidade de explorar outra fonte de inóculo inicial.
Inoculo inicial
Usar o solo do campo da sua fazenda como inóculo inicial tem duas vantagens: é gratuito e a comunidade do fungo AM que já está no solo do seu campo está adaptada ao seu clima e às condições do solo. Duas maneiras de incorporar o solo do campo no procedimento de produção de inóculo são 1) adicioná-lo à mistura de envasamento em que as mudas de capim-bahia são cultivadas antes do transplante no sistema de produção de inóculo ou 2) misturar o solo na mistura de composto e vermiculita. Ambos foram estudados em trabalhos anteriores (consulte o recurso nº 2, abaixo). A opção 1 não é atraente porque requer a coleta de solo quando os campos podem estar congelados. O projeto atual foi iniciado porque a produção de inóculo com a Opção 2 foi inconsistente.
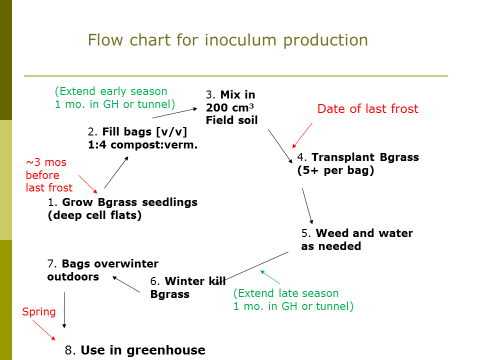
Visão geral do procedimento de produção de inóculo na fazenda
A data prevista para a instalação do sistema de produção de inóculo é logo após a ameaça de geada da primavera passar em sua área (consulte a Figura 1). Comece a produzir mudas de grama bahia três meses antes disso. Eles levam uma semana ou mais para germinar e inicialmente crescem lentamente. Então, depois que a ameaça de geada passar, encha sacos plásticos de sete galões (26.5 L) ("Grow Bags," Sunleaves Garden Products, Bloomington, IN 47404) com dois terços cheios com uma mistura 1: 4 (v / v) de composto peneirado (malha de 6.4 mm) e vermiculita, respectivamente. Em seguida, misture 200 cm3 (aproximadamente um copo) de solo de campo peneirado (mais sobre isso abaixo). Transplante suas mudas de capim-bahia para os sacos, 5 por saco. Remova as ervas daninhas e regue os sacos conforme necessário durante a estação de crescimento (veja a Figura 2). Provavelmente haverá algumas sementes de ervas daninhas germinando do composto, e o objetivo é remover essas plantas resistentes ao inverno dos sacos. O capim-bahia é então morto no inverno e os sacos hibernam no local, ao ar livre. Na primavera seguinte, as misturas de composto e vermiculita dos sacos são colhidas e misturadas em meios de envasamento de horticultura (inóculo 1: 9: meio, base de volume) para uso na estufa para produzir mudas de vegetais micorrízicos.
Este experimento
Não existe uma maneira fácil de verificar o nível da população de fungos AM no solo que você escolheu para usar como inóculo inicial, especialmente porque você o está coletando antes do uso. Portanto, o objetivo deste experimento foi testar solos de uma variedade de habitats agrícolas como inóculo inicial para a produção na fazenda de inóculo de fungos AM com o objetivo de fazer uma recomendação geral de onde coletar o solo em sua fazenda.
O solo foi coletado em 15 de junho de 2016 nos seguintes campos no Rodale Institute:
1. pasto
2. linha de cerca arborizada
3. campo plantado pela última vez com soja, seguido por uma safra de inverno para cobertura de trigo
4. campo plantado pela última vez com trigo, seguido por ervilhaca peluda durante o inverno
5. campo semeado pela última vez com milho, seguido por uma cultura de cobertura de centeio
8‑10 amostras foram coletadas por local, cada uma a uma profundidade de 6 polegadas, que foram então agrupadas. Os solos foram peneirados para passar por uma malha de 2 mm e 200 cm3 (aproximadamente um copo) foram misturados no 1/4 superior da mistura de vermiculita de um saco. Cinco sacos foram preparados para cada fonte de solo. Além disso, um conjunto de 5 sacos não recebeu solo (como controle), e outro conjunto de 20 sacos recebeu mudas de capim-bahia pré-colonizadas por um dos quatro fungos AM (5 sacos por fungo AM). Cada saco recebeu 5 mudas de capim-bahia.
A coleta de dados
Sacos de produção de inóculo foram amostrados em 15 de novembro de 2016, depois que a grama-bahia foi morta no inverno. As raízes foram analisadas quanto ao comprimento percentual da raiz colonizada por fungos AM. Amostras da mistura de composto e vermiculita de três sacos de cada tratamento / fonte de solo, bem como três amostras de uma mistura das 4 espécies de fungo AM inoculadas, foram utilizadas para conduzir bioensaios de Número Mais Provável [MPN] para determinar o número de propágulos de fungos AM por cm3 de mistura.
Resumidamente, conduzimos ensaios MPN diluindo um volume de inóculo com 9 volumes iguais de solo esterilizado e mistura de envasamento à base de areia para criar uma diluição de um décimo do original. Isso foi usado para encher 5 pequenos vasos de plantas. Uma subamostra da mistura de um décimo de diluição foi novamente misturada com 9 volumes de mistura esterilizada para produzir uma diluição de um centésimo, e depois através da diluição de um décimo de milésimo, o objetivo era diluir o inóculo original "até a extinção" ( isto é, até que os fungos AM não estejam mais presentes).
Cada vaso recebeu então uma muda de capim-bahia. As plantas cresceram por 4 semanas, após as quais todo o sistema radicular de cada vaso foi coletado e examinado para colonização por fungos AM. Eles foram pontuados simplesmente mais / menos para presença ou ausência de colonização. Tabelas estatísticas foram consultadas para produzir o número mais provável de propágulos de fungos AM por cm3 de inóculo. Uma vez que os resultados dos ensaios de MPN podem mostrar muita variabilidade de uma réplica para outra, o comprimento da raiz percentual colonizado por fungos AM de raízes na centésima diluição também foi determinado como uma medida da quantidade de fungos AM viáveis nessa diluição. Os bioensaios de MPN também foram conduzidos nas amostras originais de solo no momento da coleta em junho.
Resultados
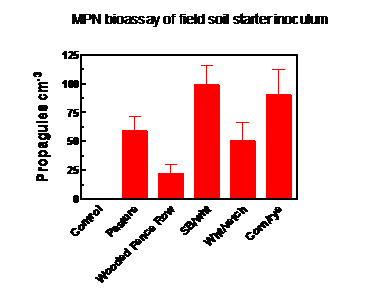
O habitat da fazenda do qual o solo foi coletado para uso como inóculo inicial teve um efeito significativo sobre a produção de inóculo. O solo das parcelas de soja / trigo e milho / centeio tinha densidade significativamente maior de propágulos de fungo AM no momento da coleta (junho de 2016) do que o solo da cerca arborizada (Figura 3), sendo os outros locais intermediários. A colonização de raízes de capim-bahia dentro dos sacos de produção de inóculo, amostrados no final da estação de crescimento, não foi significativamente diferente entre os tratamentos e variou de 39% do comprimento da raiz nos controles não inoculados a 54% no tratamento soja / trigo. Isso indicou a contaminação dos sacos de controle via raízes ou solo misturado ao composto e / ou colonização do capim-bahia do solo, através do tecido de barreira de ervas daninhas sobre o qual os sacos repousavam (ver Figura 2).
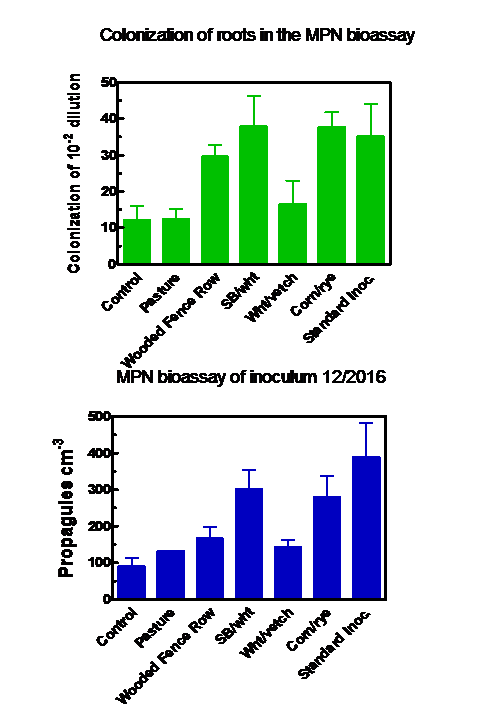
A quantificação do inóculo produzido no final da estação de crescimento por meio dos bioensaios MPN produziu resultados semelhantes, independentemente de os propágulos ou a colonização de raízes terem sido medidos (Figura 4). A melhor produção de inóculo ocorreu nos sacos que receberam as mudas pré-colonizadas (o “método padrão”) ou solo da lavoura de soja / trigo ou milho / centeio. Os solos da pastagem, da cerca arborizada e das parcelas de trigo / ervilhaca produziram níveis de inóculo que não foram estatisticamente diferentes daqueles do controle.
Conclusão
Embora isso, como todos os experimentos de campo, deva ser repetido, os resultados indicam que o solo coletado no final da primavera / início do verão de campos usados para cultivar uma safra em linha no ano anterior, seguido por uma safra de cobertura de inverno de um grão de cereal, serve como o melhor inóculo inicial para a produção on farm de fungos AM.

David Douds é um microbiologista pesquisador do USDA Agricultural Research Service em Wyndmoor PA.
