Voir la partie 1 de cette série ici.
Les champignons mycorhiziens arbusculaires [AM] sont des champignons naturels que l'on trouve dans la plupart des sols, sinon dans tous. Ils colonisent les racines de la plupart des plantes cultivées pour former une symbiose mutualiste (bénéfique pour les deux partenaires). Parmi les plantes cultivées qui ne forment pas cette symbiose, on note les membres de la famille de la moutarde (par exemple, colza, brocoli), les épinards et la betterave à sucre. Les champignons AM aident les plantes à absorber les nutriments minéraux du sol et améliorent la résistance aux maladies et à la sécheresse. Le principal avantage pour les plantes est l'absorption accrue de nutriments minéraux tels que le phosphore, le zinc et le cuivre qui sont «immobiles» dans la solution du sol; c'est-à-dire qu'ils ne se dissolvent pas bien dans l'eau du sol et ne se déplacent donc pas vers les racines lorsque les plantes retirent de l'eau du sol. En l'absence de champignons mycorhiziens, ces nutriments peuvent être absorbés à une distance de seulement 1 à 2 mm de la racine. Les brins filiformes («hyphes») des champignons AM qui sont externes à la racine s'étendent à 8 cm ou plus de la racine, augmentant considérablement le volume de sol à partir duquel ces nutriments immobiles peuvent être extraits.
Compte tenu de ces avantages, une meilleure utilisation de la symbiose AM est attrayante pour les agriculteurs, en particulier les agriculteurs biologiques qui cherchent à minimiser les intrants non agricoles. Les agriculteurs ont deux options pour cela: 1) adopter des pratiques de gestion agricole qui augmentent le fonctionnement de leurs populations indigènes de champignons AM ou 2) inoculer avec des champignons AM. Les contraintes économiques et pratiques font de l'option 1 la voie probable pour les agriculteurs de cultures en lignes. Les maraîchers qui cultivent leurs propres plants pour les transplanter au champ peuvent utiliser efficacement et économiquement des inoculums de champignons AM.
L'inoculum de champignons AM est disponible dans le commerce, mais les agriculteurs peuvent cultiver l'inoculum des champignons AM indigènes à leurs fermes en utilisant une méthode simple et fiable développée grâce à une collaboration de l'USDA et des chercheurs du Rodale Institute.
La méthode
Principes généraux
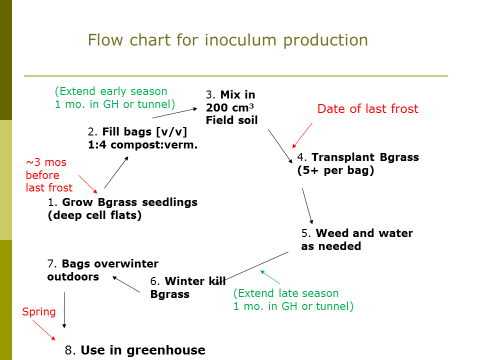
- Les champignons AM sont des «symbiotes obligatoires», ce qui signifie qu'ils doivent coloniser une plante hôte pour se développer et terminer leur cycle de vie. Cela signifie que, pour produire l'inoculum de ces champignons, il faut fournir un accès aux plantes, en particulier aux racines des plantes vivantes. Ici, nous utiliserons des plants de bahiagrass (Paspalum notatum). Bahiagrass est un bon hôte pour les champignons AM et n'est pas résistant à l'hiver dans les climats tempérés. Par conséquent, il ne deviendra pas un ravageur des mauvaises herbes dans l'inoculum. D'autres espèces de Graminacées devraient fonctionner comme plante hôte, mais on voudra être sûr d'interdire la production de graines.
- Il faut donc fournir ce dont la plante aura besoin pour pousser: les nutriments, l'eau et la lumière du soleil. Les nutriments sont fournis via le compost. Le milieu dans lequel les plantes sont cultivées, et par conséquent dans lequel l'inoculum est produit, est un mélange de 1: 4 (base volumique) de compost et de vermiculite. Placez le système de production d'inoculum en plein soleil et arrosez au besoin.
- Enfin, il faut un «inoculum de départ». La conception originale de cette méthode (voir la ressource n ° 1, ci-dessous) impliquait la production initiale des plants d'herbe de bahiagrass dans un mélange d'empotage inoculé avec des espèces individuelles de champignons AM. L'espoir était qu'après démonstration du succès de la méthode, des sources commerciales rendraient disponibles les plantes de bahiagrass «précolonisées». Cela ne s'est pas produit, d'où la nécessité d'explorer une autre source d'inoculum de démarrage.
Inoculum de démarrage
L'utilisation de la terre de votre ferme comme inoculum de démarrage présente deux avantages: elle est gratuite et la communauté de champignons AM déjà présente dans votre sol de champ est adaptée à votre climat et aux conditions du sol. Deux façons d'incorporer le sol du champ dans la procédure de production d'inoculum sont 1) de l'ajouter au terreau dans lequel les semis de bahiagrass sont cultivés avant la transplantation dans le système de production d'inoculum ou 2) pour mélanger le sol dans le mélange de compost et de vermiculite. Ils ont tous deux été étudiés dans des travaux antérieurs (voir la ressource n ° 2 ci-dessous). L'option 1 n'est pas attrayante car elle nécessite la collecte de terre lorsque les champs peuvent être gelés. Le projet actuel a été lancé parce que la production d'inoculum avec l'option 2 a été irrégulière.
Vue d'ensemble de la procédure de production d'inoculum à la ferme
La date cible pour la mise en place du système de production d'inoculum est juste après que la menace de gel printanier est passée dans votre région (voir Figure 1). Commencez à produire vos plants de bahiagrass trois mois avant cela. Ils mettent une semaine ou plus à germer et poussent initialement lentement. Ensuite, une fois la menace de gel passée, remplissez les sacs en plastique de sept gallons (26.5 L) («Grow Bags», Sunleaves Garden Products, Bloomington, IN 47404) aux deux tiers avec un mélange 1: 4 (v / v) de compost tamisé (maille de 6.4 mm) et de vermiculite, respectivement. Ensuite, mélangez 200 cm3 (environ une tasse) de terre tamisée (plus de détails ci-dessous). Transplantez vos plants de bahiagrass dans les sacs, 5 par sac. Désherbez et arrosez les sacs au besoin tout au long de la saison de croissance (voir la figure 2). Il y aura probablement des graines de mauvaises herbes germant du compost, et le but est de retirer ces plantes résistantes à l'hiver des sacs. Le bahiagrass est alors tué par l'hiver et les sacs hivernent sur place, à l'extérieur. Le printemps suivant, les mélanges de compost et de vermiculite provenant de sacs sont récoltés et mélangés dans des milieux de rempotage horticoles (inoculum 1: 9: milieu, base de volume) pour une utilisation en serre pour produire des plants de légumes mycorhiziens.
Cette expérience
Il n'y a pas de moyen simple de vérifier le niveau de population de champignons AM dans le sol que vous avez choisi d'utiliser comme inoculum de départ, d'autant plus que vous le collectez juste avant l'utilisation. Par conséquent, l'objectif de cette expérience était de tester les sols d'une variété d'habitats agricoles comme inoculum de départ pour la production à la ferme d'inoculum de champignons AM dans le but de faire une recommandation générale sur l'endroit où collecter le sol dans votre ferme.
Le sol a été collecté le 15 juin 2016 dans les champs suivants au Rodale Institute:
1. pâturage
2. rangée de clôture boisée
3. dernier champ planté en soja, suivi d'une culture de couverture de blé d'hiver
4. dernier champ planté en blé, suivi de la vesce velue hivernante
5. dernier champ planté de maïs, suivi d'un couvert végétal de seigle
De 8 à 10 échantillons ont été prélevés par site, chacun à une profondeur de 6 pouces, qui ont ensuite été regroupés. Les sols ont été tamisés pour passer une maille de 2 mm, et 200 cm3 (environ une tasse) ont été mélangés dans le quart supérieur ou plus du mélange de compost de vermiculite d'un sac. Cinq sacs ont été préparés pour chaque source de sol. De plus, un ensemble de 1 sacs n'a reçu aucun sol (comme témoin), et un autre ensemble de 4 sacs a reçu des plants d'herbe de bahiagrass précolonisés par l'un des quatre champignons AM (5 sacs par champignon AM). Chaque sac a reçu 20 plantes de bahiagrass.
Collecte de données
Les sacs de production d'inoculum ont été échantillonnés le 15 novembre 2016 après que le bahiagrass eut été tué par l'hiver. Les racines ont été analysées pour déterminer le pourcentage de longueur des racines colonisées par les champignons AM. Des échantillons du mélange de compost et de vermiculite provenant de trois sacs de chaque source de traitement / sol, ainsi que trois échantillons d'un mélange des 4 espèces de champignons AM inoculés, ont été utilisés pour effectuer des essais biologiques sur le nombre le plus probable [NPP] afin de déterminer le nombre de propagules de champignons AM par cm3 de mélange.
En bref, nous avons effectué des tests MPN en diluant un volume d'inoculum avec 9 volumes égaux d'un mélange de terreau stérilisé à base de sable et de sol pour créer une dilution au dixième de l'original. Cela a été utilisé pour remplir 5 petits pots de plantes. Un sous-échantillon du mélange de dilution au dixième a de nouveau été mélangé avec 9 volumes de mélange stérilisé pour produire une dilution au centième, puis jusqu'à la dilution au dix-millième, le but étant de diluer l'inoculum d'origine «jusqu'à l'extinction» ( c'est-à-dire jusqu'à ce que les champignons AM ne soient plus présents).
Chaque pot a ensuite reçu un plant de bahiagrass. Les plantes ont poussé pendant 4 semaines, après quoi l'ensemble du système racinaire de chaque pot a été collecté et examiné pour la colonisation par les champignons AM. Ils ont été notés simplement plus / moins pour la présence ou l'absence de colonisation. Des tableaux statistiques ont été consultés pour donner le nombre le plus probable de propagules de AM-champignons par cm3 d'inoculum. Étant donné que les résultats des dosages MPN peuvent montrer une grande variabilité d'une réplique à l'autre, le pourcentage de longueur des racines colonisées par les champignons AM des racines dans la dilution au centième a également été déterminé comme une mesure de la quantité de champignons AM viables dans cette dilution. Des bioessais MPN ont également été effectués sur les échantillons de sol originaux au moment de la collecte en juin.
Résultats
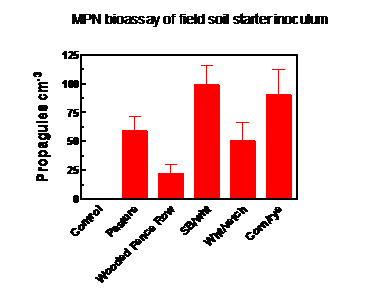
L'habitat agricole à partir duquel le sol a été recueilli pour être utilisé comme inoculum de départ a eu un effet significatif sur la production d'inoculum. Le sol des parcelles de soja / blé et de maïs / seigle présentait une densité de propagules de champignon AM significativement plus élevée au moment de la collecte (juin 2016) que le sol de la rangée de clôtures boisées (figure 3), les autres sites étant intermédiaires. La colonisation des racines de bahiagrass dans les sacs de production d'inoculum, échantillonnés à la fin de la saison de croissance, n'était pas significativement différente d'un traitement à l'autre et variait de 39% de la longueur des racines chez les témoins non inoculés à 54% dans le traitement soja / blé. Cela indiquait une contamination des sacs de contrôle via les racines ou le sol mélangé dans le compost et / ou la colonisation du bahiagrass depuis le sol, à travers le tissu de barrière contre les mauvaises herbes sur lequel reposaient les sacs (voir la figure 2).
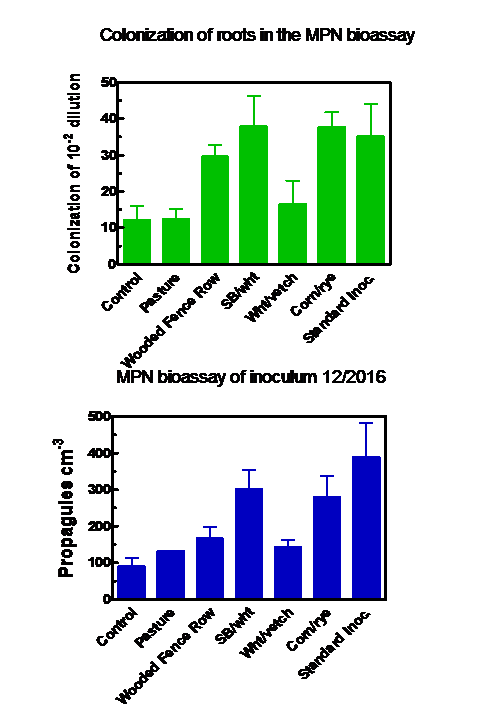
La quantification de l'inoculum produit à la fin de la saison de croissance via les bioessais MPN a produit des résultats similaires, que les propagules ou la colonisation des racines aient été mesurées (figure 4). La meilleure production d'inoculum s'est produite dans les sacs qui ont reçu les semis précolonisés (la «méthode standard») ou le sol des champs de soja / blé ou de maïs / seigle. Les sols des pâturages, des rangées de clôtures boisées et des parcelles de blé / vesce ont produit des niveaux d'inoculum qui n'étaient pas statistiquement différents de ceux du témoin.
Conclusion
Bien que cela, comme toutes les expériences sur le terrain, doive être répété, les résultats indiquent que le sol collecté à la fin du printemps / début de l'été dans les champs utilisés pour faire pousser une culture en rang l'année précédente, suivi d'une culture de couverture hivernale d'une céréale, sert de meilleur inoculum de démarrage pour la production à la ferme de champignons AM.

David Douds est un microbiologiste de recherche au USDA Agricultural Research Service à Wyndmoor PA.
