Visualizza la parte 1 di questa serie qui.
I funghi micorrizici arbuscolari [AM] sono funghi presenti in natura che si trovano nella maggior parte, se non in tutti, i terreni. Colonizzano le radici della maggior parte delle piante coltivate per formare una simbiosi mutualistica (benefica per entrambi i partner). Notevoli tra le piante coltivate che non formano questa simbiosi sono i membri della famiglia della senape (es. Colza, broccoli), spinaci e barbabietola da zucchero. I funghi AM aiutano le piante nell'assorbimento di nutrienti minerali dal suolo e migliorano la resistenza alle malattie e alla siccità. Il vantaggio principale per le piante è il maggiore assorbimento di nutrienti minerali come fosforo, zinco e rame che sono "immobili" nella soluzione del suolo; cioè, non si dissolvono bene nell'acqua nel terreno e quindi non si muovono verso le radici mentre le piante ritirano l'acqua dal suolo. In assenza di funghi micorrizici, questi nutrienti possono essere assorbiti da una distanza di soli 1-2 mm dalla radice. I filamenti filiformi (“ife”) dei funghi AM esterni alla radice si estendono per 8 cm o più lontano dalla radice, aumentando drasticamente il volume di terreno da cui è possibile estrarre questi nutrienti immobili.
Dati questi vantaggi, un migliore utilizzo della simbiosi AM è attraente per gli agricoltori, in particolare gli agricoltori biologici che cercano di ridurre al minimo gli input esterni all'azienda. Gli agricoltori hanno due opzioni per questo: 1) adottare pratiche di gestione agricola che aumentano il funzionamento delle loro popolazioni native di funghi AM o 2) inoculare con funghi AM. I vincoli economici e pratici rendono l'opzione 1 la via probabile per gli agricoltori di colture a filari. Gli orticoltori che coltivano le proprie piantine da piantare sul campo possono utilizzare in modo efficiente ed economico gli inoculi di funghi AM.
Gli inoculi di funghi AM sono disponibili in commercio, ma gli agricoltori possono coltivare l'inoculo di funghi AM indigeni nelle loro fattorie utilizzando un metodo semplice e affidabile sviluppato attraverso una collaborazione tra l'USDA e i ricercatori del Rodale Institute.
Il metodo
Principi generali
- I funghi AM sono "simbionti obbligati", nel senso che hanno bisogno di colonizzare una pianta ospite per crescere e completare i loro cicli di vita. Ciò significa che, per produrre l'inoculo di questi funghi, è necessario fornire l'accesso alle piante, in particolare alle radici delle piante viventi. Qui useremo piantine di bahiagrass (Paspalum notatum). Bahiagrass è un buon ospite per i funghi AM e non è resistente all'inverno nei climi temperati. Pertanto non diventerà un infestante infestante nell'inoculo. Altre specie di Graminacee dovrebbero funzionare come pianta ospite, ma si vorrà essere sicuri di vietare la produzione di semi.
- È quindi necessario fornire ciò di cui la pianta avrà bisogno per crescere: nutrienti, acqua e luce solare. I nutrienti vengono forniti tramite compost. Il terreno in cui vengono coltivate le piante, e quindi in cui viene prodotto l'inoculo, è una miscela di 1: 4 (volume base) di compost e vermiculite. Posizionare il sistema di produzione dell'inoculo in piena luce solare e acqua se necessario.
- Infine, è necessario un "inoculo iniziale". Il progetto originale di questo metodo (vedi risorsa n. 1, di seguito) prevedeva la produzione iniziale delle piantine di bahiagrass in una miscela di invasatura inoculata con singole specie di funghi AM. La speranza era che, dopo aver dimostrato il successo del metodo, le fonti commerciali rendessero disponibili le piante di bahiagrass “precolonizzate”. Ciò non è avvenuto, quindi la necessità di esplorare un'altra fonte di inoculo starter.
Inoculo di avviamento
Usare il terreno del campo della tua fattoria come inoculo iniziale ha due vantaggi: è gratuito e la comunità di funghi AM già nel tuo terreno del campo è adattata al tuo clima e alle condizioni del suolo. Due modi per incorporare il terreno del campo nella procedura di produzione dell'inoculo sono 1) aggiungerlo al terriccio in cui vengono coltivate le piantine di bahiagrass prima del trapianto nel sistema di produzione dell'inoculo o 2) mescolare il terreno al composto e alla miscela di vermiculite. Entrambi sono stati studiati in lavori precedenti (vedere la risorsa n. 2, di seguito). L'opzione 1 non è attraente perché richiede la raccolta del terreno quando i campi possono essere congelati. Il progetto attuale è stato avviato perché la produzione di inoculo con l'opzione 2 è stata incoerente.
Panoramica della procedura di produzione dell'inoculo in azienda
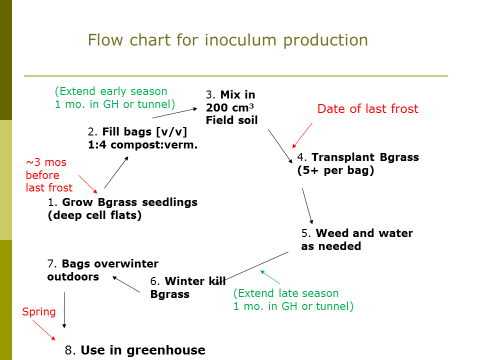
La data obiettivo per la configurazione del sistema di produzione dell'inoculo è subito dopo che la minaccia del gelo primaverile è passata nella tua zona (vedi Figura 1). Inizia a produrre le tue piantine di bahiagrass tre mesi prima. Richiedono una settimana o più per germogliare e inizialmente sono coltivatori lenti. Quindi, dopo che la minaccia del gelo è passata, riempire per due terzi i sacchetti di plastica da sette galloni (26.5 L) ("Grow Bags," Sunleaves Garden Products, Bloomington, IN 47404) con una miscela 1: 4 (v / v) rispettivamente di compost schermato (maglia da 6.4 mm) e vermiculite. Quindi, mescolare 200 cm3 (circa una tazza) di terreno setacciato (più su quello sotto). Trapianta le piantine di bahiagrass nei sacchetti, 5 per sacchetto. Elimina le erbacce e innaffia i sacchi secondo necessità durante la stagione di crescita (vedi Figura 2). Probabilmente ci saranno dei semi di erbe infestanti che germinano dal compost e l'obiettivo è rimuovere queste piante resistenti all'inverno dai sacchetti. La bahiagrass viene quindi uccisa in inverno e le borse svernano sul posto, all'aperto. La primavera successiva, le miscele di compost e vermiculite dai sacchi vengono raccolte e mescolate in terriccio orticolo (inoculo 1: 9: terreno, base volume) da utilizzare in serra per produrre piantine di ortaggi micorrizate.
Questo esperimento
Non esiste un modo semplice per controllare il livello della popolazione di funghi AM nel terreno che hai scelto di utilizzare come inoculo iniziale, soprattutto perché lo stai raccogliendo appena prima dell'uso. Pertanto, l'obiettivo di questo esperimento era di testare i suoli di una varietà di habitat agricoli come inoculo iniziale per la produzione in azienda di inoculo di funghi AM con l'obiettivo di fornire una raccomandazione generale su dove raccogliere il suolo nella vostra azienda agricola.
Il suolo è stato raccolto il 15 giugno 2016 dai seguenti campi presso il Rodale Institute:
1. pascolo
2. fila di recinzione boscosa
3. campo seminato per ultimo a soia, seguito da un raccolto di copertura di grano invernale
4. campo seminato per ultimo a grano, seguito da veccia pelosa svernante
5. campo seminato per ultimo a mais, seguito da un raccolto di copertura di segale
Sono stati raccolti 8-10 campioni per sito, ciascuno fino a una profondità di 6 pollici, che sono stati poi raggruppati. Il terreno è stato setacciato per passare una maglia di 2 mm, e 200 cm3 (circa una tazza) sono stati mescolati nella parte superiore 1/4 o giù di lì della miscela di compost vermiculite di un sacchetto. Sono stati preparati cinque sacchi per ciascuna fonte di suolo. Inoltre, un set di 5 sacchi non ha ricevuto terreno (come controllo) e un altro set di 20 sacchi ha ricevuto piantine di bahiagrass precolonizzate da uno dei quattro funghi AM (5 sacchi per fungo AM). Ogni borsa ha ricevuto 5 piante di bahiagrass.
Raccolta dei dati
I sacchetti per la produzione di inoculo sono stati campionati il 15 novembre 2016 dopo che l'erba di bahia era stata uccisa durante l'inverno. Le radici sono state analizzate per la lunghezza percentuale delle radici colonizzate da funghi AM. Campioni della miscela di compost e vermiculite da tre sacchi di ciascuna fonte di trattamento / suolo, nonché tre campioni di una miscela delle 4 specie di funghi AM inoculate, sono stati utilizzati per condurre saggi biologici del numero più probabile [MPN] per determinare il numero di propaguli di funghi AM per cm3 di miscela.
In breve, abbiamo condotto i saggi MPN diluendo un volume di inoculo con 9 volumi uguali di un terriccio sterilizzato e una miscela di impregnazione a base di sabbia per creare un decimo di diluizione dell'originale. Questo è stato utilizzato per riempire 5 piccoli vasi per piante. Un sottocampione della miscela di un decimo di diluizione è stato nuovamente miscelato con 9 volumi di miscela sterilizzata per produrre una centesima diluizione, e attraverso la diluizione di un decimillesimo, l'obiettivo era di diluire l'inoculo originale "fino all'estinzione" ( cioè fino a quando i funghi AM non sono più presenti).
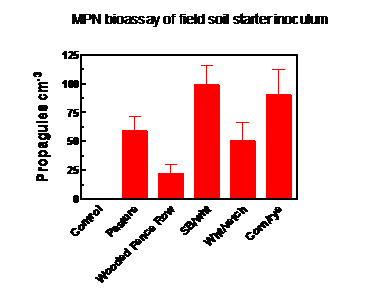
Ogni vaso ha poi ricevuto una piantina di bahiagrass. Le piante sono cresciute per 4 settimane, dopodiché l'intero apparato radicale di ogni vaso è stato raccolto ed esaminato per la colonizzazione da parte dei funghi AM. Sono stati valutati semplicemente più / meno per la presenza o l'assenza di colonizzazione. Le tabelle statistiche sono state consultate per fornire il numero più probabile di propaguli di funghi AM per cm3 di inoculo. Poiché i risultati dei saggi MPN possono mostrare molta variabilità da un replicato all'altro, la lunghezza percentuale della radice colonizzata dai funghi AM delle radici nella centesima diluizione è stata determinata anche come misura della quantità di funghi AM vitali in quella diluizione. Anche i biotest MPN sono stati condotti sui campioni di terreno originali al momento della raccolta nel mese di giugno.
Risultati
L'habitat agricolo da cui è stato raccolto il terreno per essere utilizzato come inoculo iniziale ha avuto un effetto significativo sulla produzione di inoculo. Il suolo degli appezzamenti di soia / grano e mais / segale aveva una densità significativamente maggiore di propaguli di funghi AM al momento della raccolta (giugno 2016) rispetto al suolo della fila di recinzione boscosa (Figura 3), gli altri siti essendo intermedi. La colonizzazione delle radici di bahiagrass all'interno dei sacchi di produzione di inoculo, campionata alla fine della stagione di crescita, non era significativamente diversa tra i trattamenti e variava dal 39% della lunghezza delle radici nei controlli non inoculati al 54% nel trattamento con soia / grano. Ciò indicava la contaminazione dei sacchi di controllo attraverso le radici o il terreno mescolato al compost e / o la colonizzazione dell'erba bahia dal suolo, attraverso il tessuto barriera delle erbe infestanti su cui poggiavano i sacchi (vedere Figura 2).
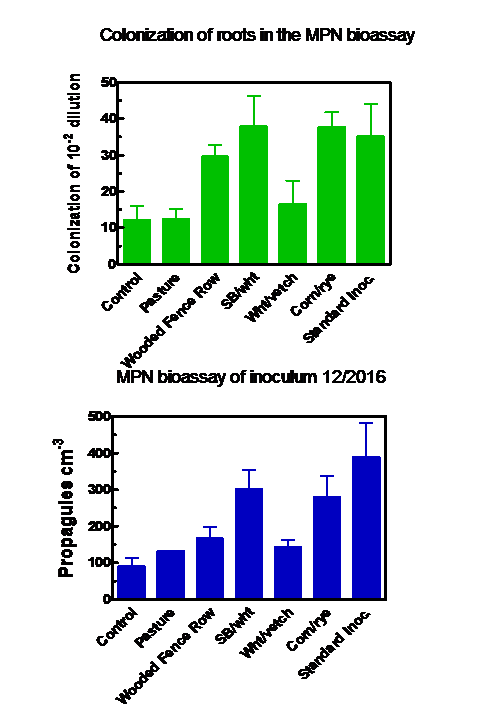
La quantificazione dell'inoculo prodotto alla fine della stagione di crescita tramite i test biologici MPN ha prodotto risultati simili indipendentemente dal fatto che siano stati misurati i propaguli o la colonizzazione delle radici (Figura 4). La migliore produzione di inoculo è avvenuta nei sacchi che hanno ricevuto le piantine precolonizzate (il “metodo standard”) o il terreno dei campi di soia / grano o mais / segale. I terreni del pascolo, del filare di recinzione boscosa e degli appezzamenti di grano / veccia hanno prodotto livelli di inoculo che non erano statisticamente diversi da quelli del controllo.
Conclusione
Anche se questo, come tutti gli esperimenti sul campo, dovrebbe essere ripetuto, i risultati indicano che il terreno raccolto in tarda primavera / inizio estate dai campi utilizzati per coltivare un raccolto in fila l'anno precedente, seguito da un raccolto di copertura svernante di un cereale, serve come miglior inoculo iniziale per la produzione in azienda di funghi AM.

David Douds è un microbiologo ricercatore presso l'USDA Agricultural Research Service di Wyndmoor PA.
